TAUTOMER
TAUTOMER
Tautomer adalah senyawa-senyawa
organik yang dapat melakukan reaksi antarubahan
yang disebut tautomerisasi.
Seperti yang umumnya dijumpai, reaksi ini dihasilkan oleh perpindahan atom hidrogenatau proton yang
diikuti dengan pergantian ikatan
tunggal dengan ikatan ganda di
sebelahnya. Dalam larutan di mana tautomerisasi dapat terjadi, kesetimbangan kimia tautomer
dapat dicapat. Rasio tautomer ini tergantung pada beberapa faktor, meliputi temperatur, pelarut,
dan pH.
Konsep tatomer yang dapat melakukan antarubahan dengan tautomerisasi disebut tautomerisme. Tautomerisme adalah
kasus khusus dari isomersime struktur dan
memainkan peran yang penting dalam pemasangan
basa dalam molekul DNA dan RNA.
Tautomerisasi dikatalisasi oleh:
·
Basa (1. deprotonasi;
2. pemebntukan anion yang
terdelokalisasi (misalnya enolat);
3. protonasipada posisi yeng
berbeda pada anion).
·
asam (1. protonasi;
2. pembentukan kation yang terdelokalisasi; 3. deprotonasi pada sebelah posisi
yang berbeda pada kation).
Pasangan tautomer yang umum adalah:
·
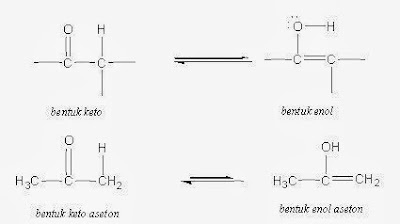
keton - enol, misalnya aseton (lihat: tautomerisme keto-enol).
·
amida - asam imidat,
misalnya selama reaksi hidrolisis nitril.
·
laktam - laktim, sebuah
tautomerisme amida-asam imidat pada cincin heterosiklik,
misalnya pada nukleobasa guanina, timina, dan sitosina..
·
enamina -
enamina, misalnya selama reaksi enzim yang
dikatalisasi oleh piridoksalfosfate.
ü Tautomerisme
prototropik merujuk
pada relokasi sebuah proton, seperti pada contoh di atas, dan dapat dianggap
sebagai subbagian dari perilaku asam-basa. Tautomer
prototropik adalah sekelompok keadaan protonasi isomerik
dengan rumus empiris dan muatan total yang
sama.
ü Tautomerisme
annular adalah
sejenis tautomerisme prototropik di mana sebuah proton dapat menduduki dua atau
lebih posisi dalam sebuah sistem heterosiklik.
Sebagai contoh, 1H- dan 3H- imidazola;
1H-, 2H-, dan 4H- 1,2,4-triazola; 1H- dan
2-H isoindola.
ü Tautomerisme
rantai-cincin terjadi
ketika perpindahan proton diikuti oleh perubahan struktur terbuka menjadi
cincin, seperti pada bentuk aldehida dan piran glukosa.
ü Tautomerisme
valensi adalah
sejenis tautomerisme prototropik yang melibatkan proses reorganisasi ikatan
elektron yang cepat. Contoh dari jenis tautomerisme ini dapat ditemukan pada bulvalena. Contoh lainnya
adalah bentuk terbuka dan tertutup dari azida - tetrazola. Tautomerisme
valensi memerlukan perubahan geometri molekul dan hal ini berbeda dengan struktur resonansi ataupun mesomer.
Suatu
senyawa karbonil dengan suatu hidrogen alfa yang bersifat asam, dapat berada
dalam dua bentuk yang disebut tautomer : suatu tautomer keto dan sebuah
tautomer enol. Tautomer adalah isomer-isomer yang berbeda satu dengan
yang lainnya hanya pada posisi ikatan rangkap dan sebuah atom hidrogen
berhubungan. Tautomer keto suatu senyawa karbonil mempunyai struktur karbonil
seperti diharapkan. Tautomer enol (dari –ena+-ol) yang merupakan
suatu alcohol vinilik, terbentuk dengan serah-terima sebuah hidrogen asam dari
karbon α ke oksigen karbonil. Karena atom hidrogen berada dalam posisi yang
berlainan, kedua bentuk tautometrik ini bukanlah struktur-resonansi, melainkan
dua struktur berlainan yang berada dalam kesetimbangan. (harus diingat bahwa
struktur-struktur resonansi berbeda hanya dalam posisi elektron).
Tautomeri adalah
perpindahan atom dalam satu molekul menjadi isomer. contohnya perubahan keto
menjadi enol, amin menjadi imin.
Kuantitas relative enol
versus keto dalam suatu cairan murni dapat diperkirakan dengan spektroskopi
inframerah atau nmr. Aseton terutama ada dalamketo (99,99% menurut prosedur
titrasi khusus). Kebanyakan aldehida dan keton yang sederhana juga terutama ada
dalam bentuk keto; tetapi, 2,4-pentanadion terdiri dari 80% enol! Bagaimana
perbedaan besar ini dapat dijelaskan? Perhatikan struktur tautomer
2,4-pentanadion:
Bentuk enol tidak hanya
memiliki ikatan rangkap berkonjugasi, yang sedikit menambah kestabilan, tetapi
juga memiliki susunan yang sedemikian rupa sehingga mmemungkinkan terbentuknya
ikatan hidrogen internal, yang membantu menstabilkan tautomer ini.Tatomeri dapat
mempengaruhi kereaktivan suatu senyawa. Suatu pengecualian terhadap sifat
keton yang tidak mudah teroksidasi, ialah oksidasi keton yang memiliki
sekurang-kurangnya suatu hidrogen alfa. Suatu keton yang dapat menjalani
tautomeri dapat dioksidasi oleh zat-pengoksidasi kuat pada ikatan rangkap
karbon-karbon (dari) tautomer enolnya. Rendemen reaksi ini tidak diguakan untuk
kerja sinetik, tetapi sering digunakan dalam penuturan struktur.
sumber :
Fessenden &
Fessenden, Kimia Organik., Jodhi Pramusaji Giriarso, kamus Kimia SMA.
http://atom-green.blogspot.co.id/2013/10/tautomeri.html




terima kasih semoga bermanfaat
BalasHapusmaterinya sangat bermanfaat, terimakasih dan semangat ya
BalasHapusTerimakasih materi nya sangat membantu :)
BalasHapusMaterinya sangat bermanfaat.
BalasHapusterima kasih atas ilmu yang diberikan, Kalau bisa mohon lebih dijelaskan lagi, terima kasih
BalasHapusterima kasih atas info ilmunya, sangat bermanfaat
BalasHapusTerima kasih atas sharing ilmunya. Semoga kedepannya lebih baik lagi dan senantiasa memposting hal-hal yang bermanfaat. semangat:)
BalasHapus