GUGUS FUNGSI
Salah satu
bahasan dalam kimia organik, yang membedakan dengan kimia anorganik adalah
adanya sebuah pola yang disebut deret homolog. Setiap senyawa organik mempunyai
gugus yang spesifik dimana setiap gugus tersebut berbeda sifat dan
reaktivitasnya. Inilah yang disebut gugus fungsional. Gugus fungsi adalah suatu
atom atau kumpulan atom yang melekat pada suatu senyawa dan berperan memberikan
sifat yang khas pada senyawa.
Semua senyawa organik yang mempunyai gugus fungsional yang
sama akan ditempatkan pada deret homolog yang sama. Berdasarkan gugus fungsi,
dapat dibuat klasifikasi senyawa organik yang memudahkan kimia organik untuk
dipelajari.
Gugus fungsional:
adalah konfigurasi spesifik atom-atom yang umumnya berikatan dengan kerangka
karbon molekul organik dan umumya terlibat dalam reaksi kimiawi • Persenyawaan
dengan gugus fungsional yang sama akan mempunyai sifat kimia yang sama.
Alkohol
• Alkohol adalah
persenyawaan organik yang mempunyai satu atau lebih gugus hidroksil.
• Karena ikatan
hidroksil di sini bersifat kovalen, maka sifat alkohol tidak serupa dengan hidroksida,
tetapi lebih mendekati sifat air.
• Alkohol dapat
digolongkan berdasarkan:
1. Letak gugus OH pada atom karbon
2. Banyaknya gugus OH
yang dimiliki.
3. Bentuk rantai karbonnya
SIFAT FISIKA
1. Titik didih
alkohol relatif tinggi.Hal ini merupakan akibat langsung dari daya tarik
intermolekuler yang kuat.
2. Semua alkohol
adalah polar tetapi tidak semua alkohol dapat larut dalam.
·
SIFAT KIMIA
1. Dehidrasi
alkohol.
2. Oksidasi alkohol.
3. Reaksi alkohol
dengan logam Na&K.
4. Esterifikasi
REAKSI-REAKSI
Reaksi-reaksi yang
terjadi dalm alkohol antara lain reaksi substitusi, reaksi eliminasi, reaksi
oksidasi dan esterifikasi. Dalam suatu alkohol, semakin panjang rantai
hidrokarbon maka semakin rendah kelarutannya. Bahkan jika cukup panjang sifat
hidrofob ini mengalahkan sifat hidrofil dari gugus hidroksil. Banyaknya gugus
hidroksil dapat memperbesar kelarutan dalam air (Hart, 1990).
A. Reaksi Oksidasi
Suatu alkohol
primer dapat dioksidasi menjadi aldehid atau asam karboksilat. Alkohol sekunder
dapat dioksidasi menjadi keton saja. Sedangkan pada alkohol tersier menolak
oksidasi dengan larutan basa, dalam larutan asam, alkohol mengalami dehidrasi
menghasilkan alkena yang kemudian dioksidasi (Fessenden, 1997).
Beberapa oksidasi dari alkohol antara lain :
a. Oksidasi menjadi
aldehid
Hasil oksidasi mula-mula dari alkohol primer adalah suatu
aldehid (RCH=O). Aldehid, siap dioksidasi menjadi asam karboksilat. Oleh sebab
itu, reaksi antara alkohol primer dengan zat oksidator kuat akan menghasilkan
asam karboksilat, dan bukan intermediet aldehid. Pereaksi tertentu harus
dipakai apabila intermediet aldehid merupakan hasil yang diinginkan.
b. Oksidasi menjadi
keton.
Suatu alkohol sekunder dioksidasi oleh oksidator yang
reaktif kuat menjadi keton.
c. Oksidasi menjadi
asam karboksilat.
Aldehida
Aldehida
merupakan senyawa organik yang memiliki gugus karbonil terminal. Gugus fungsi
ini terdiri dari atom karbon yang berikatan dengan atom hidrogen dan berikatan
rangkap dengan atom oksigen. Golongan aldehida juga dinamakan golongan formil
atau metanoil. Kata aldehida merupakan kependekan dari alcohol dehidrogenasi
yang berarti alkohol yang terdehidrogenasi. Golongan aldehida bersifat polar.
Sifat Fisik Aldehida
Aldehida dengan 1-2 atom karbon (formaldehida, dan
asetaldehida) berwujud gas pada suhu kamar dengan bau tidak enak.
Aldehida dengan 3-12 atom karbon berwujud cair pada suhu
kamar dengan bau sedap.
Aldehida dengan atom karbon lebih dari 12 berwujud padat
pada suhu kamar.
Aldehida suku rendah (formaldehida, dan asetaldehida) dapat
larut dalam air.
Aldehida suku tinggi tidak larut air.
Sifat Kimia aldehida
Oksidasi oleh kalium bikromat dan asam sulfat
Oksidasi aldehida dengan campuran kalium bikromat dan asam
sulfat akan menghasilkan asam
Eter
Eter dapat
digilongkan menjadi dua jenis, yaitu eter simetris dan eter asimetris. Kalau
dalam rumus umum eter R = R', maka eter tersebut dinamakan eter sederhana atau
eter simetrik. Tetapi bila R ≠ R', dinamakan eter campuran atau eter asimetrik.
Di samping yang mempunyai gugus alkil (R) terdapat pula eter yang mengandung
gugus aril (Ar) yang rumus umumnya dinyatakan dengan Ar-O-Ar' atau Ar-O-'R.
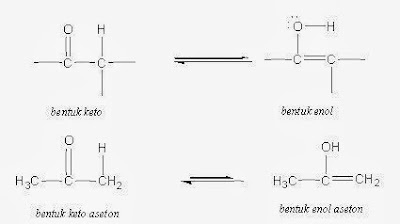
Keton
Aldehida dan keton merupakan nama dua golongan senyawa
organik yang masing-masing mengandung unsur-unsur C, H, dan O. Kedua golongan
senyawa ini mempunyai gugus fungsi C=O, oleh karena itu, di antara keduanya
terdapat beberapa persamaan sifat.
Rumus umum aldehida adalah R-CHO dan untuk keton adalah
R-C(=O)R'. Dari rumus umum tersebut dapat diketahui perbedaan atara atom/gugus
yang terikat pada gugus karbonil dalam aldehida dan keton. Perbedaan inilah
yang mengakibatkan aldehida dan keton tidak memiliki sifat-sifat yang identik.
Asam Karboksilat
Asam karboksilat adalah suatu senyawa organik yang
mengandung gugus karbonil (-COOH ), misalnya : asam formiat, asam asetat, asam
propionnat, asam butirat, dan lain-lain. Asam asetat dapat dihasilkan dengan
mereaksikan Na-asetat dengan K-hidrosulfat. Suatuester karboksilat adalah suatu
senyawa yang mengandung gugus -COOR dengan R yang berupa alkil atau aril. Ester
ini dapat di bentuk dengan mereaksikan langsung suatu asam karboksilat dengan
suatu alkohol. Reaksi ini di sebut reaksi esterifikasi, yang berkataliskan asam
dan bersifat reversibel.
Reaksi Esterifikasi
Esterifikasi adalah reaksi pengubahan dari suatu asam
karboksilat dan alkohol menjadi suatu ester dengan menggunakan katalis asam.
Reaksi ini juga sering disebut esterifikasi Fischer. Ester adalah suatu senyawa
yang mengandung gugus -COOR dengan R dapat berbentuk alkil maupun aril. Suatu
ester dapat dibentuk dengan reaksi esterifikasi berkatalis asam. Reaksi
esterifikasi merupakan reaksi dapat balik (reversible).
Laju esterifikasi suatu asam karboksilat bergantung terutama
pada halangan sterik dalam alkohol dan asam karboksilatnya. Kuat asam dari asam
karboksilat hanya memainkan peranan kecil dalam pembentukan ester. Untuk alasan
sterik, urutan reaktivitas alkohol untuk reaksi esterifikasi adalah metanol
> alkohol 1º > alkohol 2º > alkohol 3º.
Alkana
Senyawa organik
yang paling sederhana adalah hidrokarbon. Hidrokarbon hanya terdiri dari dua
unsur, yaitu karbon (C) dan hidrogen (H). Hidrokarbon jenuh atau yang disebut
dengan alkana adalah hidrokarbon yang keseluruhan ikatannya adalah ikatan
tunggal. Masing-masing karbon membentuk empat ikatan dan masing-masing hidrogen
membentuk satu ikatan dengan karbon. Ikatan pada masing-masing hidrokarbon
adalah tetrahedralReaksi Terhadap Alkana.
Alkana sangat tidak reaktif terhadap sebagian besar
pereaksi. Alkana merupakan senyawa nonpolar dan hanya memiliki ikatan-ikatan
sigma yang kuat. Alkana dapat bereaksi dengan oksigen dan halogen pada kondisi
tertentu. Inilah beberapa reaksi yang bisa dilakukan terhadap senyawa golongan
alkana.
Halogenasi
Alkana bereaksi dengan halogen di bawah pengaruh panas atau
sinar ultraviolet. Contoh:
CH4 + Cl2 → CH3Cl + HCl
Pada contoh reaksi di atas terjad ipenggantian satu atom H
pada metana oleh atom halogen. Reaksi ini termasuk reaksi substitusi dan karena
substitusinya halogen, maka disebut dengan halogenasi.
Nitrasi
Reaksi alkana dengan HNO3 pada suhu 150-475˚ C mengakibatkan
terjadinya substitusi atom H pada alkana oleh gugus -NO2 (gugus nitro). Reaksi
substitusi semacam ini dinamakan reaksi nitrasi,dan secara umum dituliskan
dengan persamaan reaksi:
R-H + HO-NO2 → R-NO2 + H2O
Sulfonasi
Reaksi alkana
dengan asam sulfat pekat berasap (oleum) menghasilkan asam alkana sulfonat dan
dituliskan dengan persamaan reaksi umum:
R-H + HO-SO3H → RSO3H + H2O
Dalam reaksi di atas terjadi substitusi satu atom H pada
alkana oleh gugus -SO3H dan subsritusi ini dinamakan sulfonasi.
Isomer Cis-Trans
Isomer
sistem cis-trans adalah cara yang paling umum digunakan untuk menujukkan
konfigurasi alkena. Cis mengandung pengertian bahwa substituen terletak pada
bidang yang sama, sedangkan trans mengandung pengertian bahwa substituen
terletak pada bidang yang berseberangan. Dengan sistem ini tidak lagi dijumpai
keraguan isomer manakah yang diberi nama cis-2-butena dan manakah
trans-3-heksena.
Alkena
Gugus fungsi alkena yang utama adalah adanya ikatan rangkap
dua antar karbon (C=C). Gugus fungsi ini sangat mempengaruhi reaksi pada
golongan alkena. Secara umum, reaksi yang dapat terjadi pada alkena dapat
dikategorikan menjadi dua jenis, yaitu reaksi pada ikatan rangkap dan reaksi di
luar ikatan rangkap. Reaksi alkena yang terjadi pada ikatan rangkap dinamakan
reaksi adisi, sedangkan di luar katan rangkap dinamakan reaksi substitusi.
Alkuna
Alkuna adalah suatu golongan hidrokarbon alifatik yang
mempunyai gugus fungsi berupa ikatan ganda tiga karbon-karbon (-C≡C-). Seperti
halnya ikatan rangkap dalam alkena, ikatan ganda tiga dalam alkuna juga disebut
ikatan tidak jenuh. Ketidakjenuhan ikatan ganda tiga karbon-karbon lebih besar
daripada ikatan rangkap. Oleh karena itu kemampuannya bereaksi dengan
pereaksi-peraksi yang dapat bereaksi dengan alkena juga lebih besar. Hal inilah
yang menyebabkan golongan alkuna memiliki peranan khusus dalam sintesis senyawa
organik.
Alkohol
Rumus umum alkohol adalah R-OH, dimana R adalah gugus alkil,
alkenil, atau alkunal. Pada kasus substitusi alkena dan alkuna hanya terjadi
pada karbon jenuh (karbon yang tak memiliki ikatan rangkap). Sebagai contoh,
propanol memiliki rumus struktur CH3-CH2-CH2-OH. Sedangkan 2-propenol memiliki
rumus struktur CH2=CH-CH2-OH. Dan 2-propunol memiliki rumus struktur
CH≡C-CH2-OH.
Eter
Eter dapat digilongkan menjadi dua jenis, yaitu eter
simetris dan eter asimetris. Kalau dalam rumus umum eter R = R', maka eter
tersebut dinamakan eter sederhana atau eter simetrik. Tetapi bila R ≠ R',
dinamakan eter campuran atau eter asimetrik. Di samping yang mempunyai gugus
alkil (R) terdapat pula eter yang mengandung gugus aril (Ar) yang rumus umumnya
dinyatakan dengan Ar-O-Ar' atau Ar-O-'R.
Aldehid dan Keton
Aldehida dan keton merupakan nama dua golongan senyawa
organik yang masing-masing mengandung unsur-unsur C, H, dan O. Kedua golongan
senyawa ini mempunyai gugus fungsi C=O, oleh karena itu, di antara keduanya
terdapat beberapa persamaan sifat.
Rumus umum aldehida adalah R-CHO dan untuk keton adalah
R-C(=O)R'. Dari rumus umum tersebut dapat diketahui perbedaan atara atom/gugus
yang terikat pada gugus karbonil dalam aldehida dan keton. Perbedaan inilah
yang mengakibatkan aldehida dan keton tidak memiliki sifat-sifat yang identik.
Asam Karboksilat
Asam Karboksilat
disebut golongan asam alkanoat. Asam karboksilat merupakan senyawa
karbon yang mempunyai gugus karboksil – COOH. Istilah karboksil berasal dari
duagugus, yaitu gugus karbonil (-CO-) dan gugus hidroksil (-OH). Asam
karboksilat merupakan turunan dari alkana dimana sebuah atom H dari alkana
diganti gugus – COOH. Rumus umum asam karboksilat adalah R-COOH atau CnH2nO2.
Reaksi Esterifikasi
Esterifikasi adalah reaksi pengubahan dari suatu asam
karboksilat dan alkohol menjadi suatu ester dengan menggunakan katalis asam.
Reaksi ini juga sering disebut esterifikasi Fischer. Ester adalah suatu senyawa
yang mengandung gugus -COOR dengan R dapat berbentuk alkil maupun aril. Suatu
ester dapat dibentuk dengan reaksi esterifikasi berkatalis asam. Reaksi
esterifikasi merupakan reaksi dapat balik (reversible).
Laju esterifikasi suatu asam karboksilat bergantung terutama
pada halangan sterik dalam alkohol dan asam karboksilatnya. Kuat asam dari asam
karboksilat hanya memainkan peranan kecil dalam pembentukan ester. Untuk alasan
sterik, urutan reaktivitas alkohol untuk reaksi esterifikasi adalah metanol
> alkohol 1º > alkohol 2º > alkohol 3º.
DAFTAR PUSTAKA
Maulana, Puri.2013.
Contoh Kegunaan dan Manfaat Senyawa Organik di Bidang Kesehatan, Obat-obatan,
Kimia. http://perpustakaancyber.com/2013/04/contoh-kegunaan-dan-manfaat-senyawa-organik-di-bidang-kesehatan-obat-obatan-kimia.html
Sumbono, aung.2012.Kimia Organik 1.
http://aungsumbono.blogspot.com/
Triantoro, anggit.2010. Sejarah Kimia
Organik.http://anggittriantoro.blogspot.com/


Apakah ada contoh yg lebih di mengerti dari pembahasan di atas?
BalasHapusApakah ada contoh yg lebih di mengerti dari pembahasan di atas?
BalasHapusApakah ada contoh yg lebih di mengerti dari pembahasan di atas?
BalasHapusTerima kasih atas pemaparan materinya. Dapatkah anda menjelaskan mengenai isomer gugus fungsi?
BalasHapusterima kasih:)