KONSEP KONSEP STRUKTUR MOLEKUL SENYAWA ORGANIK
Senyawa Organik
Senyawa organik adalah
golongan besar senyawa kimia
yang molekulnya mengandung karbon, kecuali karbida, karbonat, dan oksida
karbon. Studi mengenai senyawaan organik
disebut kimia organik. Banyak di
antara senyawaan organik,
seperti protein, lemak, dan karbohidrat, merupakan komponen penting dalam
biokimia.
Konsep
Konsep Struktur Molekul Senyawa Organik
A. Elektronegativitas
Elektronegativitas atau keelektronegatifan
(Simbol: χ) adalah sebuah sifat kimia yang menjelaskan kemampuan sebuah atom (atau lebih jarangnya
sebuah gugus fungsi)
untuk menarik elektron (atau rapatan elektron) menuju dirinya sendiri pada
ikatan kovalen. Konsep elektronegativitas pertama kali diperkenalkan oleh Linus Pauling
pada tahun 1932 sebagai bagian dari perkembangan teori ikatan valensi. Elektronegativitas
tidak bisa dihitung secara langsung, melainkan harus dikalkulasi dari
sifat-sifat atom dan molekul lainnya. Beberapa metode kalkulasi telah diajukan.
Walaupun pada setiap metode terdapat perbedaan yang kecil dalam nilai numeris
elektronegativitasnya, semua metode memiliki tren periode
yang sama di antara unsur-unsur. Elektronegativitas merupakan salah
satu sifat periodisitas unsur, selain afinitas
elektron, jari-jari atom, dan energi
ionisasi.
Metode yang umumnya sering
digunakan adalah metode Pauling. Hasil perhitungan ini menghasilkan nilai yang
tidak berdimensi
dan biasanya dirujuk sebagai skala
Pauling dengan skala relatif yang berkisar dari 0,7 sampai dengan 4,0
(hidrogen = 2,2). Bila metode perhitungan lainnya digunakan, terdapat sebuah
konvensi (walaupun tidak diharuskan) untuk menggunakan rentang skala yang sama
dengan skala Pauling: hal ini
dikenal sebagai elektronegativitas dalam satuan Pauling. Elektronegativitas bukanlah bagian dari sifat atom, melainkan
hanya merupakan sifat atom pada molekul. Sifat pada atom tunggal yang setara
dengan elektronegativitas adalah afinitas
elektron. Elektronegativitas pada sebuah unsur akan bervariasi
tergantung pada lingkungan kimiawi,namun biasanya dianggap sebagai sifat yang terpindahkan,
yaitu sebuah nilai elektronegativitas dianggap akan berlaku pada berbagai
situasi yang bervarias.
Polarisasi dan
Elektronegativitas Pada bab ini, kita akan mempelajari lebih lanjut tentang
ikatan ionic dan ikatan kovalen. Ikatan dalam natrium klorida adalah ikatan
ionic. Natrium menransfer elektron ke klorin menghasilkan Na+ dan Cl- , yang
akan terikat satu sama lain karena adanya gaya tarik elektrostatik yang kuat.
Ikatan C-C dalam etana merupakan contoh ikatan kovalen. Elektron dalam ikatan
tersebut dimiliki bersama oleh kedua atom C. Akibatnya terjadi distribusi
elektron yang simetris di dalam ikatan. Ikatan kovalen polar artinya elektron
ikatan dipegang lebih kuat oleh salah satu atom, mengakibatkan distribusi
elektron di antara kedua atom tidak simetris.
Polaritas ikatan ditentukan
oleh elektronegativitas atom-atom yang terlibat. Seperti yang terlihat pada
tabel 2.1, karbon dan hidrogen memiliki elektronegativitas yang mirip, sehingga
ikatan C-H relatif nonpolar. Unsur-unsur yang berada pada bagian kanan dalam
tabel periodik, seperti oksigen, fluorin, dan klorin memiliki kemampuan menarik
elektron (elektronegativitas) lebih besar dibandingkan dengan karbon. Dengan
demikian, ketika atom karbon berikatan dengan salah satu dari atom tersebut
maka terbentuk ikatan yang terpolarisasi. Elektron akan cenderung tertarik ke
atom yang lebih elektronegatif. Dalam molekul tersebut, atom karbon bermuatan
parsial positif (+)dan atom yang lebih elektronegatif bermuatan parsial
negatif(- ). Contohnya, ikatan C-Cl adalah ikatan polar.
Tanda panah digunakan untuk
menunjukan arah polaritas. Berdasarkan kesepakatan, arah pergerakan elektron
searah dengan arah panah. Unsur-unsur yang berada pada bagian kiri dalam tabel
periodik bersifat kurang elektronegatif dibandingkan karbon. Dengan demikian,
ketika karbon berikatan dengan mereka, elektron akan cenderung tertarik ke
karbon dan mengakibatkan atom karbon bermuatan parsial negatif. Elektronegativitas
beberapa unsur Ketika kita membicarakan tentang kemampuan atom menyebabkan
polarisasi ikatan, kita gunakan istilah efek induksi. Unsur-unsur
elektropositif seperti litium dan magnesium menginduksi pemberian elektron,
sedangkan unsur-unsur 43 elektronegatif seperti oksigen dan klorin menginduksi
penarikan elektron. Efek induksi sangat penting untuk memahami reaktivitas
suatu senyawa.
B.Ikatan Hydrogen
Ikatan hidrogen adalah gaya
tarik menarik yang lemah antara atom elektronegatif (seperti atom fluor,
oksigen, atau nitrogen, dan atom hidrogen) terikat pada atom elektronegatif
lain. Ikatan hidrogen bertanggung jawab atas sifat yang dimiliki air dan banyak
molekul biologis lainnya.
Dalam kimia, ikatan hidrogen adalah sejenis gaya
tarik antarmolekul
atau antar dipol-dipol yang terjadi antara dua muatan listrik parsial dengan
polaritas yang berlawanan. Walaupun lebih kuat dari kebanyakan gaya
antarmolekul, ikatan hidrogen jauh lebih lemah dari ikatan
kovalen dan ikatan ion. Dalam makromolekul seperti protein
dan asam nukleat,
ikatan ini dapat terjadi antara dua bagian dari molekul yang sama. dan berperan
sebagai penentu bentuk molekul keseluruhan yang penting.
Ikatan hidrogen terjadi ketika sebuah molekul
memiliki atom N, O, atau F yang mempunyai pasangan elektron bebas (lone pair
electron). Hidrogen dari molekul lain akan berinteraksi dengan pasangan
elektron bebas ini membentuk suatu ikatan hidrogen dengan besar ikatan
bervariasi mulai dari yang lemah (1-2 kJ mol−1) hingga tinggi
(>155 kJ mol−1).Kekuatan ikatan hidrogen ini dipengaruhi oleh
perbedaan elektronegativitas antara atom-atom dalam molekul tersebut. Semakin
besar perbedaannya, semakin besar ikatan hidrogen yang terbentuk.
Ikatan hidrogen memengaruhi titik didih suatu
senyawa. Semakin besar ikatan hidrogennya, semakin tinggi titik didihnya.
Namun, khusus pada air (H2O), terjadi dua ikatan hidrogen pada tiap
molekulnya. Akibatnya jumlah total ikatan hidrogennya lebih besar daripada asam
florida (HF) yang seharusnya memiliki ikatan hidrogen terbesar (karena paling
tinggi perbedaan elektronegativitasnya) sehingga titik didih air lebih tinggi
daripada asam florida.Ikatan hidrogen juga sangat berpengaruh pada
spektroskopi. Contoh yang paling nyata adalah pada spektroskopi inframerah, di mana adanya
ikatan hidrogen akan memperlebar stretching.
C.Gaya Van Der Waals
Gaya van der Waals adalah
interaksi lemah antara molekul yang melibatkan dipol. Molekul polar memiliki
interaksi dipol-dipol permanen. Perangkat pencitraan resonansi magnetik (NMR)
menggunakan nitrogen cair untuk mendinginkan magnet superkonduktor. Nitrogen
adalah gas pada suhu kamar dan mencair pada suhu -195,8 ° C. Tetangganya pada
tabel periodik (oksigen) mendidih pada suhu -182,95 ° C. Interaksi antara
molekul nitrogen (N2) lebih lemah, sehingga titik didihnya menjadi
lebih rendah. Interaksi antara molekul non-polar tergantung pada tingkat
fluktuasi elektron dalam molekul.Jenis pertama dari gaya antarmolekul yang kita
akan membahas disebut van der Waals, setelah kimiawan Belanda Johannes van der
Waals (1837-1923). Gaya van der Waals adalah gaya antarmolekul yang paling
lemah dan terdiri dari gaya dipol-dipol dan gaya dispersi.
Gaya dipol-dipol adalah gaya
tarik menarik yang terjadi antara molekul polar. Sebuah molekul hidrogen
klorida memiliki atom hidrogen sebagian positif dan atom klor sebagian negatif.
Dalam kumpulan banyak molekul hidrogen klorida, mereka akan mensejajarkan diri
agar daerah bermuatan sebaliknya dari molekul tetangga berdekatan satu sama
lain.
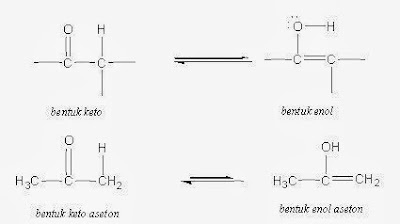
Suatu
senyawa karbonil dengan suatu hidrogen alfa yang bersifat asam, dapat berada
dalam dua bentuk yang disebut tautomer : suatu tautomer keto dan sebuah
tautomer enol. Tautomer adalah
isomer-isomer yang berbeda satu dengan yang lainnya hanya pada posisi ikatan
rangkap dan sebuah atom hidrogen berhubungan. Tautomer keto suatu senyawa
karbonil mempunyai struktur karbonil seperti diharapkan. Tautomer enol (dari –ena+-ol) yang merupakan suatu alcohol vinilik, terbentuk dengan
serah-terima sebuah hidrogen asam dari karbon α ke oksigen karbonil. Karena
atom hidrogen berada dalam posisi yang berlainan, kedua bentuk tautometrik ini
bukanlah struktur-resonansi, melainkan dua struktur berlainan yang berada dalam
kesetimbangan. (harus diingat bahwa struktur-struktur resonansi berbeda hanya
dalam posisi elektron).
Didalam
kamus kimia SMA, tautomeri
adalah perpindahan atom dalam satu molekul menjadi isomer. contohnya perubahan
keto menjadi enol, amin menjadi imin.
Kuantitas
relative enol versus keto dalam suatu cairan murni dapat diperkirakan dengan
spektroskopi inframerah atau nmr. Aseton terutama ada dalamketo (99,99% menurut
prosedur titrasi khusus). Kebanyakan aldehida dan keton yang sederhana juga
terutama ada dalam bentuk keto; tetapi, 2,4-pentanadion terdiri dari 80% enol!
Bagaimana perbedaan besar ini dapat dijelaskan? Perhatikan struktur tautomer
2,4-pentanadion:
Bentuk
enol tidak hanya memiliki ikatan rangkap berkonjugasi, yang sedikit menambah
kestabilan, tetapi juga memiliki susunan yang sedemikian rupa sehingga
mmemungkinkan terbentuknya ikatan hidrogen internal, yang membantu menstabilkan
tautomer ini.
E.Resonansi
Resonansi adalah peristiwa ikut bergetarnya suatu benda karena ada
benda lain yang bergetar dan memiliki frekuensi yang sama atau kelipatan
bilangan bulat dari frekuensi itu. Resonansi
sangat bermanfaat dalam kehidupan sehari-hari. Misalnya, resonansi bunyi pada kolom udara dapat
dimanfaatkan untuk menghasilkan bunyi.
F.Hiperkonyugasi
Hiperkonjugasi adalah ikatan C – C apabila mengikat atom lagi
dengan ikatan rangkap 2 atau 3. C-C kecil dari pada C-C perhitungan karena
adanya pengaruh ikatan rangkap dua atau tiga yaitu elektron. atau pengaruh hiperkonjugasi. Terjadi semacam
resonansi.
G.Mesomeri
ü Ditinjau dari sudut induksi,seharusnya
m.nitrofenol memiliki keasaman lebih kuat daripada p.nitrofenol karena jarak
ikatan m-nitrofenol lebih dekat.Tapi kenyataanya sebaliknya.Ini disebabkan oleh
faktor mesomeri H mudah lepas
ü Kenyataan juga menunjukkan bahwa kebasaan
anilin jauh lebih besar daripada kebasAaan benzilanilin:pKa 9,37 50000 x lebih
kecil kebasaannya
ü Ditinjau dari efek induksi (-I) hanya sedikit
perbedaanya, kenyataannya terlalu besar. Ini disebabkan oleh faktor efek
mesomeri ion anilin
H. Efek Induksi
Pergeseran
elektron secara permanen sepanjang
cincin terjadi jika atom atau gugus
dengan kelektronegatifan yang berbeda dengan atom karbon cincin disebut
efek induksi. Elektron tertarik ke arah Cl, disebut juga –I.Jika
kelektronegatifan atom atau gugus yang terikat pada rantai karbon lebih kecil
dari atom karbon, maka pergeseran elektron menjauhi gugus sepanjang rantai,
yang dikenal sebagai efek induksi (+I)
ü
Efek
induktif dapat menjelaskan perbedaan antara kekuatan asam antara etilamina (pKa
~ 40) dan amonia (pKa ~ 33).
ü
Nilai
pKa menunjukkan bahwa keasaman amonia lebih kuat dari etilamina. Pada kasus ini efek induksi adalah efek pendorong elektron.
ü
Gugus
alkil pada etilamina meningkatkan muatan negatif basa konyugasi , sehingga
mendestabilisasinya, membuat etilamina lebih lemah keasamannya dibanding amonia
Daftar Pustaka
http://gigihkurniawan.blogspot.co.id/2013/11/Resonansi-Konjugasi-Hiperkonjugasi.html
Hart, Harold. 2004. Kimia Organik. Jakarta:
Erlangga
H. Pine, Stanley dkk.1998. Kimia Organik 2 Edisi ke-4.
Bandung. ITB
Parnowo, Harno D.
2007. Kimia Organik Fisik. Yogyakarta: Universitas Gadjah Mada


bermanfaat sekali kak.tapi warna tulisannya ga sama kak, mohon diperbaiki lagi ya kak
BalasHapusTerikasih alis ,mohon maaf jika ada kekurangan di pembuatan blog ini semoga kedepannya saya bisa lebih baik memperbaikinya
HapusSilaauuu nop. Hehehe
BalasHapusTerimakasih kasih komentar nya
HapusMungkin kedepannya saya berusaha membuat blognya lebih baik lagi
Komentar ini telah dihapus oleh pengarang.
Hapusjelaskan hubungan keelektronegatifan suatu unsur berdasarkan elektron valensinya? mohon penjelasnnya terimakasih :)
BalasHapusAssalamualaikum nesya gubungan keelektronegatif bedasarakana elektron valensinya yaitu
HapusAssalamulaikum kakk :D
BalasHapusilmunya Sangat bermanfaat
Saya Ingin Bertanya, Kenapa penjelasannya sedikit kurang dimengerti, tolong jelaskan sedikit lebih rinci heheh...
maaf sebelumnya, hyperkoyugasi disitu dijelaskan terjadi semacam resonansi. jadi apa ya perbedaan keduanya? terimakasih
BalasHapusTulisan tulisan hehehe... sudah bagus kok kak, cie ngeblog 😜😜
BalasHapusTerimakasih atas materinya. Mau tanya pengertian mesomeri itu apa ya? Seberapa besar pengaruh nya terhadap keasaman suatu senyawa? Terimakasih
BalasHapussaya masih belum mengerti mengenai resonansi.. apa kah saya blh tau, pengaruh resonansi itu apa saja ya?
BalasHapusMaaf, bagaimana menjelaskan efek induksi pada keto dan enol pada tautomeri ya? Trmksh
BalasHapusTerima kasih atas penjelasannya,saya ingin bertanya apakah ada faktor yang mempengaruhi terjadinya regangan ruang? Terima kasih
BalasHapusterimakasih atas ilmunya, sangat menarik untuk dipelajari
BalasHapusTerima kasih
BalasHapusMaterinya sangat bagus dan beanfaat
Terima kasih
BalasHapusMaterinya sangat bagus dan bermanfaat
Terima kasih
BalasHapusMaterinya sangat bagus dan bermanfaat